Global News
阿尔茨海默病是老年人群体中最为普遍的神经退行性疾病。特别值得关注的是,那些携带APOE-ε4等位基因的人群,其罹患该疾病的风险显著增高。据科学研究显示,若个体携带一个APOE-ε4等位基因,其患病风险将增加2-3倍;若携带两个APOE-ε4等位基因,患病风险更是会提升至8-12倍。然而,值得注意的是,尽管有部分人群携带了两个APOE-ε4等位基因,却依然能够幸免于阿尔茨海默病的侵袭,似乎他们的身体天生具备对该疾病的“抵抗力”。
最近,由哥伦比亚大学科学家领导的一个研究团队,在对这类特殊老年人群体的深入研究中,揭示了保护他们免受阿尔茨海默病侵害的原因。这一发现不仅为我们提供了新的视角去认识这一疾病,同时也为预防和治疗阿尔茨海默病的研究开辟了新的可能途径。研究人员认为,这一重要发现或将成为未来阿尔茨海默病防治研究的新靶点。

本研究对携带两个APOE-ε4等位基因、年龄超过七十岁的健康老人进行了DNA序列分析,发现他们的DNA中普遍存在与细胞外基质(ECM)信号通路相关的基因变异,特别是FN1基因上的罕见变异rs140926439。此变异可降低阿尔茨海默病的发病风险并推迟发病时间。研究还发现,APOE-ε4等位基因数量与BBB中纤连蛋白水平呈正相关,但携带FN1基因变异的老人大脑BBB中纤连蛋白水平未显著升高。研究人员推测BBB中纤连蛋白水平可能与大脑中淀粉样蛋白沉积有关,这是阿尔茨海默病的典型特征之一。

图片来源:123RF
经过周密实验验证,科研团队在斑马鱼的阿尔茨海默病模型中,敲除了与人类FN1基因相对应的同源基因。实验结果表明,斑马鱼在缺失该基因后,其清除淀粉样蛋白的能力有了显著提升,与此同时,负责清理淀粉样蛋白的小胶质细胞活性也得以增强。此外,斑马鱼身上出现的与阿尔茨海默病患者相似的胶质增生(gliosis)等病理性变化也有所减轻。进一步对rs140926439变异的分析显示,这一变异可能导致纤连蛋白的失活或功能受损。综合以上实验结果,研究团队认为,FN1基因上的rs140926439基因突变,可能通过使纤连蛋白失活,降低其在BBB(血脑屏障)中的沉积水平,并激活小胶质细胞的活性,从而增强了大脑清除淀粉样蛋白的能力,达到了预防阿尔茨海默病发生的潜在效果。
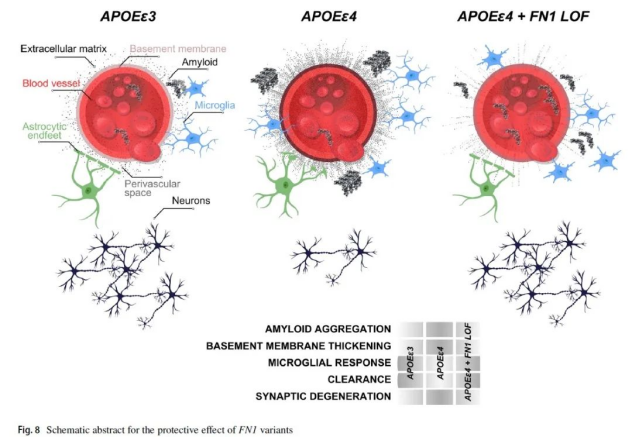
研究人员指出,尽管这一特定的基因突变是在分析携带APOE-ε4等位基因的人群中发现的,但其潜在影响可能波及更广大的人群。现有研究已经揭示,不论是否携带APOE-ε4等位基因,认知能力正常的人群与阿尔茨海默病患者之间的BBB纤连蛋白沉积水平存在显著差异。因此,那些旨在减少纤连蛋白沉积的治疗方法有可能对携带其他类型APOE等位基因的人群同样产生积极效果。
在人类遗传学研究领域,针对特定靶点进行新药开发的策略已经取得了显著成功。例如,PCSK9这一重要的心血管疾病治疗靶点,最初是在2003年被发现的。研究人员当时观察到,PCSK9基因的突变会导致PCSK9蛋白表达水平上升,进而促进低密度脂蛋白胆固醇(LDL-C)的升高,最终可能引发家族性高胆固醇血症(FH)。不久后,另一研究团队报告称,在少数人群中自然存在抑制PCSK9表达的基因突变,这些人群具有极低的LDL-C水平,心血管疾病发病率也显著降低,且未显示其他不良作用。
针对PCSK9靶点的抗体疗法和RNAi疗法已获美国FDA批准上市,口服小分子疗法和能够永久降低PCSK9蛋白表达的基因编辑疗法也正处于临床开发阶段,并已展现出积极的治疗前景。我们期待,当前研究中揭示的阿尔茨海默病新靶点能在后续研究中得到进一步验证,从而推动创新疗法的开发,为更多患者带来福音。