Global News

《自然》杂志最新发表的研究揭示了APOE4/4基因型阿尔茨海默病患者大脑中小胶质细胞异常积累脂滴(LDAM)的新机制。这一机制表明,在受到淀粉样蛋白(Aβ)和其他先天免疫因子刺激后,异常的小胶质细胞会促进神经细胞中Tau蛋白的磷酸化和细胞死亡。这一发现为理解APOE4基因如何诱发阿尔茨海默病提供了新的视角,并为开发潜在的治疗策略提供了基础。
APOE蛋白是一种重要的脂质和胆固醇转运蛋白,而APOE4是编码该蛋白的一种等位基因形式。这种基因形式改变了APOE蛋白转运胆固醇和脂质的能力,与阿尔茨海默病的发生发展密切相关。为了深入研究APOE基因型与阿尔茨海默病之间的关系,科学家们对APOE4/4基因型AD患者的额叶皮质组织进行了单细胞核RNA测序。通过将这一患者群体的转录子组数据与APOE3/3基因型AD患者以及APOE3/3基因型的健康人进行比较,研究团队发现了小胶质细胞异常积累脂滴的关键作用。
这一发现不仅揭示了APOE4基因诱发阿尔茨海默病的全新机制,还为探索有效的治疗方法提供了新的思路。通过进一步深入研究这一机制,科学家们有望开发出针对APOE4基因型阿尔茨海默病的有效治疗方法,为这一严重神经退行性疾病的治疗带来新的希望。
图片来源:123RF
经过对小胶质细胞转录子组的详尽分析,我们发现APOE4/4基因型AD患者的小胶质细胞中,表达水平变化最为显著的基因为ACSL1。ACSL1是一个关键的脂质处理酶编码基因,它在脂滴的生物合成过程中扮演了至关重要的角色。若ACSL1过度表达,将促进多种细胞类型中富含甘油三酯的脂滴形成。进一步的脂质染色分析揭示,在AD患者的大脑组织中,存在更多细胞表现出脂质体的累积现象。值得注意的是,细胞中脂质体的数量与患者在认知评估中的表现呈负相关,且脂质体的水平与β淀粉样蛋白斑块的数量和Tau蛋白的病理水平均呈正相关关系。
为了深入探讨APOE基因型对小胶质细胞中脂滴积累的影响,研究团队运用先进的细胞分化技术,从APOE4/4和APOE3/3基因型的诱导多能干细胞中成功分化出小胶质细胞(iMG)。通过脂质染色检测,我们发现APOE4/4基因型的小胶质细胞中脂滴积累程度显著高于APOE3/3基因型。更为关键的是,当这些iMG受到纤维状Aβ刺激时,脂滴的积累会显著增加,特别是在携带APOE4等位基因的细胞中,脂滴积累现象更为突出。然而,若敲除APOE基因,则纤维状Aβ刺激不会导致脂滴的积累。这些发现为我们深入了解AD的发病机制提供了新的视角,并为未来的治疗策略开发提供了重要线索。
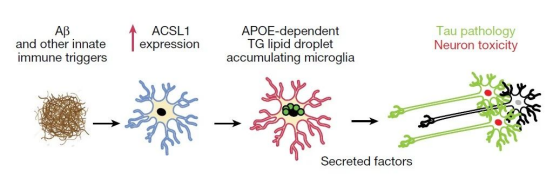
进一步研究显示,脂滴积累的iMG能够分泌具有神经毒性的物质,在细胞培养实验中导致周围的神经细胞中磷酸化Tau蛋白的水平增加以及细胞凋亡。基于这些数据,研究人员提出了脂滴聚集的小胶质细胞介导AD病理发生的新模型。在这一模型中,Aβ激活小胶质细胞中的甘油三酯脂质合成,脂滴积累以及神经毒性因子的释放。这一系列过程依赖APOE来完成。而释放的神经毒性因子激发了神经退行性病变的标志性特征。
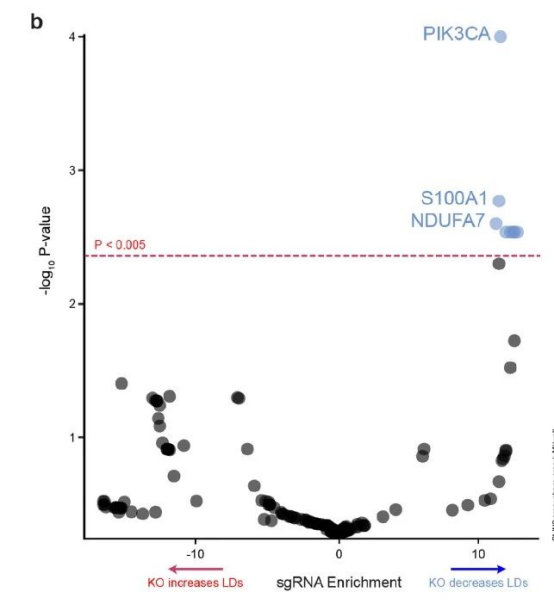
如果小胶质细胞中的脂滴积累是激发神经退行性病变的关键,那么有什么手段能够减少脂滴积累呢?为此研究人员进行了CRISPR筛选,寻找可以降低脂滴积累的基因。对约2000个可成药基因进行筛选后,研究人员发现编码PI3激酶(PI3K)催化亚基的PIK3CA基因是脂滴积累的遗传调节因子。
在小鼠模型中,抑制PI3K已被验证可以调节巨噬细胞中的脂滴积累。科学家们决定检测在人类小胶质细胞中抑制PI3K是否有同样的作用。实验结果显示,一款名为GNE-317的小分子PI3K抑制剂显著降低APOE4/4基因型小胶质细胞受到纤维状Aβ刺激后的脂滴生成。而且,GNE-317能够逆转已经有高水平脂滴积累的小胶质细胞中的促炎性细胞因子分泌。进一步研究显示,GNE-317能够降低与脂质合成相关的基因表达以及促炎性细胞因子的生成,同时提高脂质降解、促进小胶质细胞稳态和神经保护的生长因子的表达。GNE-317处理后,与自噬作用相关的基因表达水平也有所提高。这意味着GNE-317可能通过提高自噬作用来降低脂滴水平。
经过深入探索,科研人员发现,过去关于APOE的研究多集中于星形胶质细胞、内皮细胞、神经细胞和少突触细胞,而当前研究则揭示了APOE通过调控小胶质细胞内脂滴累积,从而可能诱发阿尔茨海默病(AD)的新机制。此外,抑制人类小胶质细胞中的PI3K信号通路能有效提升自噬作用相关基因的表达水平,并降低脂滴的累积。尽管自噬作用被视为延缓神经退行性疾病进程的潜在途径之一,但先前的研究主要集中于自噬介导的蛋白降解。因此,进一步探索小胶质细胞中自噬介导的脂质降解机制,有望为阐明AD的发病机制提供新的视角。
研究人员同时指出,APOE基因型对AD病理的影响可能涉及多种不同的生物学机制,不同细胞类型在AD发病过程中可能展现出各自独特的作用方式。未来,仍需深入探索各种细胞类型间的相互作用及其对疾病进程的贡献,以便更全面地理解AD的发病机制。